|
Il
simbolo pH si usa in chimica per indicare la maggiore o minore acidità
delle soluzioni acquose.
Il pH fu ideato dal
chimico danese
Søren P. L. Sørensen nel 1909, il quale stava affrontando
alcuni problemi relativi al processo di fermentazione della birra.
Questo processo richiede un controllo molto accurato dell'acidità dei
mosti, la quale, a quel tempo, veniva espressa attraverso la
concentrazione degli ioni H+ presenti in soluzione. Questi
ioni, normalmente, sono in quantità molto piccola e vengono indicati,
usando le parentesi quadre per simboleggiare le concentrazioni molari,
attraverso espressioni del tipo:
[H+]
= 10-5 mol/L
il che
significa che in un litro di acqua vi è un centomillesimo di mole di
ioni H+. La mole è una grandezza molto usata in chimica e
corrisponde a circa seicentomila miliardi di miliardi di particelle,
numero che corrisponde a quello di Avogadro (6,022·1023).
Sørensen si rese immediatamente conto che i calcoli si sarebbero di
molto semplificati facendo riferimento al solo esponente del valore
della concentrazione, anziché a tutto il numero. Propose quindi di
chiamare questo esponente pH, dove p sta per potenza cioè esponente del
10, (dal latino pondus) e H sta per idrogeno, o meglio, per ione
idrogeno, (dal latino Hydrogenii).
Oggi,
il pH viene definito come l'opposto del logaritmo, in base 10, della
concentrazione molare degli ioni idrogeno. Pertanto:
pH =
- Log [H+]
La
concentrazione suddetta permette di definire il grado di acidità o basicità della
soluzione e può assumere valori appartenenti
all’intervallo [10-1,
10-14]
che copre ben 14 ordini di grandezza. Più precisamente, una soluzione si
dice acida se la concentrazione assume valori nell'intervallo [10-1,
10-6],
neutra se assume valore 10-7
e basica se assume valori nell'intervallo [10-8,
10-14].
Anziché esprimere direttamente il valore della concentrazione, si è
preferito definire una nuova grandezza, indicata dal simbolo “pH” e
definita dalla relazione
pH =
-log[H+]
Ne segue che il pH
della maggior parte delle soluzioni che si incontrano in pratica è
compreso, per quanto già detto circa la concentrazione degli ioni
idrogeno, tra 1 e 14.
Discende, inoltre,
dalla definizione che quanto più basso è il pH tanto più acida è la
soluzione. Per esempio, una soluzione a pH = 1 ha una concentrazione di
ioni idrogeno H+ 100 volte superiore rispetto ad una soluzione a pH = 3.
Siccome spesso
interessa pure la concentrazione degli ioni ossidrile [OH-]
si pone
pOH =
-log[OH-]
Siccome, dalle
leggi dell’equilibrio chimico, si sa che il prodotto delle due concentrazioni
rimane costante e pari al valore:
[H+]
×
[OH-]
= 1,0
·
10-14,
possiamo calcolare
il logaritmo di entrambi i membri e trovare
log{[H+]
×
[OH-]}
=
-14
dalla quale
discende la relazione
log[H+] + log[OH-]
= -14.
Moltiplicando per
-1
e a seguito delle definizioni di pH e pOH risulta
pH + pOH = 14.
La seguente tabella evidenzia la
corrispondenza tra i
valori delle concentrazioni molari [H+], il pH e il pOH.
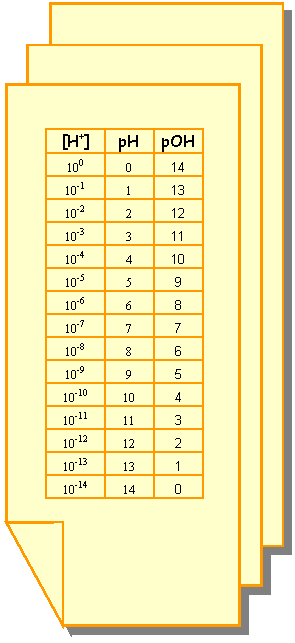
È
interessante notare il passaggio dalla progressione geometrica di
ragione 10-1, evidente
nella prima colonna, a quella aritmetica di ragione 1, nella seconda
colonna: il logaritmo, infatti, trasforma processi geometrici in
processi aritmetici.
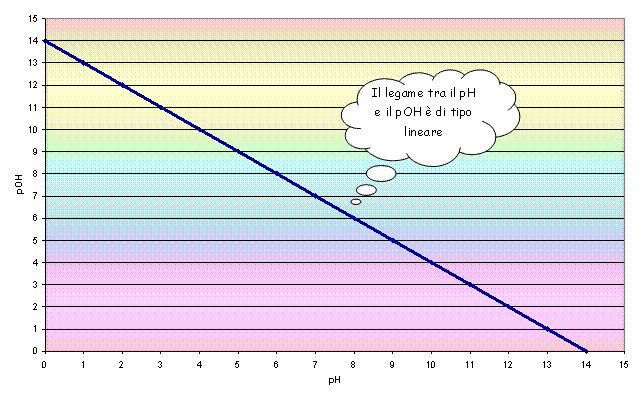
Il grafico sottostante
mette in evidenza il legame lineare tra il
pH e il pOH:
La conoscenza del pH riveste grande importanza sia teorica sia pratica
perché consente di spiegare numerose reazioni e perché dalla
concentrazione idrogenionica delle soluzioni dipende la vita stessa
degli organismi viventi. Ogni processo biologico e molte trasformazioni
chimiche subiscono infatti profonde alterazioni per variazioni anche
minime della concentrazione idrogenionica del mezzo in cui enzimi o
altre sostanze devono operare. Le soluzioni acquose, in particolare,
hanno bisogno di un costante controllo del pH in quanto tali soluzioni
rappresentano un costituente essenziale degli organismi viventi.
|
[H+] |
100
|
10-1
|
10-2
|
10-3
|
10-4
|
10-5
|
10-6
|
10-7
|
10-8
|
10-9
|
10-10
|
10-11
|
10-12
|
10-13
|
10-14
|
|
pH |
0
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
ACIDITA’
|
|
BASICITA’
|
|
Indicatore
universale
di pH
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L'acqua pura ha pH = 7, ma l'acqua di cui l'uomo fa uso per
soddisfare le sue necessità vitali non è acqua pura, ma acqua che
contiene disciolti, anche se in concentrazioni molto basse, sali ed
altre sostanze che ne modificano il pH. Quando il valore del pH esce
da certi
limiti, l'acqua non è più potabile e potrebbe anche essere dannosa oltre
che per l’uomo pure per le piante e per gli animali. Il controllo del pH
è, quindi, importante in molte lavorazioni che interessano i prodotti
alimentari, i terreni e, più in generale, tutti quei composti chimici che
l'uomo giornalmente manipola.
 |
