|
Ogni atomo è formato da
un nucleo comprendente protoni e neutroni e da elettroni che ruotano
intorno al nucleo. I protoni e gli elettroni possiedono carica
elettrica, positiva i primi e negativa i secondi. I neutroni invece sono
privi di carica.
In natura non tutti i
nuclei sono stabili. Un nucleo non stabile è destinato a decadere in un
altro nucleo con minore massa mediante l’emissione di una radiazione. La
radioattività o decadimento radioattivo, dunque, è un insieme di
processi tramite i quali dei
nuclei atomici
instabili (nuclidi)
emettono
particelle subatomiche
per raggiungere uno stato più stabile.
In base alle leggi della meccanica quantistica
il decadimento spontaneo di un nucleo è un processo puramente casuale;
da ciò discende che, mentre è praticamente impossibile determinare
l’istante in cui un particolare nucleo si disintegra, si può invece
predire la probabilità che un certo numero di atomi di una data specie
si disintegri in un dato intervallo di tempo.
Ciò premesso, consideriamo un campione
costituito da un numero N0 molto grande di atomi di un
determinato isotopo radioattivo.
Dopo un piccolo intervallo di tempo Δt, un
certo numero di atomi è decaduto e di conseguenza il numero di atomi
dell’elemento originario diventa Nt in quanto è variato di
una quantità che indichiamo con
N0
- Nt = -(Nt-N0)
= –ΔN.
Qualunque sia la natura dell’isotopo, il
numero degli atomi decaduti è proporzionale al numero N0 di atomi inizialmente presenti e
all’intervallo di tempo Δt.
La legge di decadimento,
che si ricava ricorrendo al calcolo integrale, é data da
Nt = N0e-λt
dove
λ è
una costante positiva di proporzionalità caratteristica dell’elemento
considerato, chiamata costante di decadimento. Tale legge
mostra come, partendo da
N0 atomi, il numero Nt
di atomi presenti all’istante t, che non si sono cioè ancora
disintegrati, decresce esponenzialmente nel tempo.
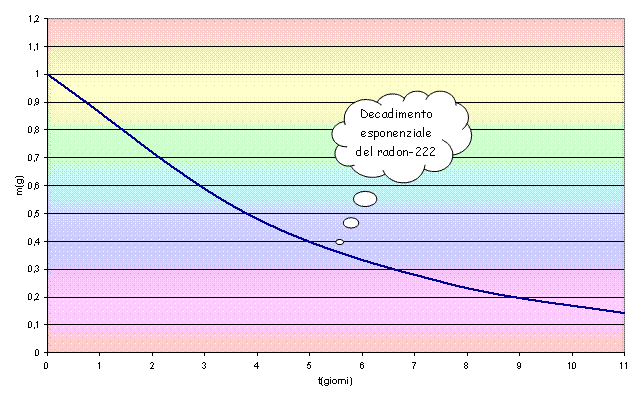
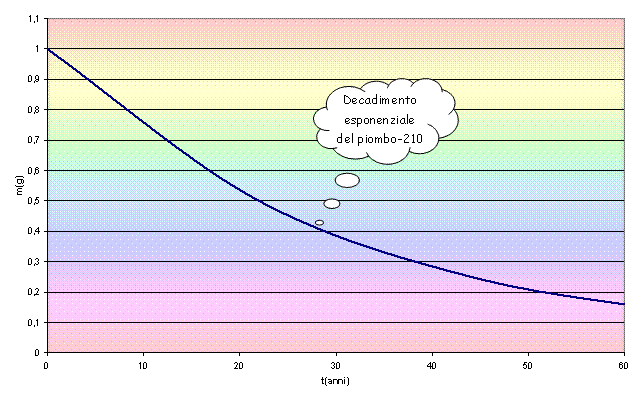
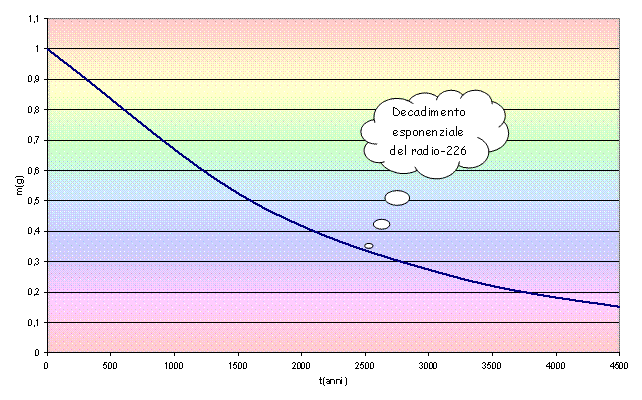
Riportiamo ora alcuni
grafici riferiti alla legge di decadimento di alcuni elementi
radioattivi.
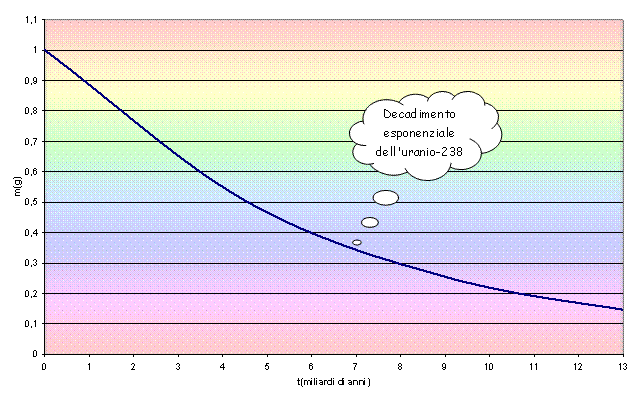
Un
parametro importante per la caratterizzazione di un nucleo radioattivo è
il tempo di dimezzamento T½ , ossia il tempo impiegato dal
numero di nuclei N0 per ridursi a metà
N(T½)=
N0 /2.
Per
esempio, se si parte con un grammo di sostanza radioattiva, dopo che
sarà trascorso un tempo pari al suo tempo di dimezzamento resterà di
quell' isotopo solo mezzo grammo.
Dalla legge di
decadimento
Nt = N0e-λt,
ponendo Nt = N0/2 e t = T½=
T segue
N0/2 = N0e-lT
Cioè
½ = e-lT
e, prendendo i
logaritmi naturali da ambo i membri, si ha
lT
= ln2
da cui
T = T½
= 0,693/l
Dalla precedente
deriva che, come la costante di disintegrazione
l, anche il periodo di dimezzamento dipende solo dalla
natura dell’isotopo considerato.
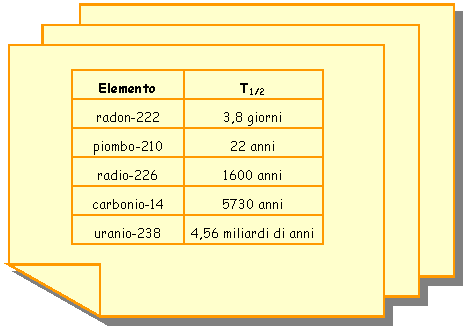
La seguente tabella
indica i tempi di dimezzamento di alcuni elementi radioattivi.
Il carbonio è l’elemento
costituente fondamentale di tutti i materiali di origine organica e
dunque degli organismi viventi. In natura si trovano mescolati fra loro
tre isotopi del carbonio: il carbonio 12C, il carbonio
13C e il carbonio 14C. Quest’ultimo, più raro, è
radioattivo e si forma nell’atmosfera terrestre. Nell’alta atmosfera i
raggi cosmici producono neutroni, n, che nella bassa atmosfera
partecipano alla seguente reazione nucleare:
147N
+ n ----> 146C + p
dove un atomo di azoto
14N viene trasformato nel carbonio radioattivo 14C.
I nuclei 14C
non appena formati si combinano con l’ossigeno dell’aria per formare
l’anidride carbonica radioattiva 14CO2 che si
mescola poi uniformemente con l’anidride carbonica.
Perciò, tutti i vegetali
incorporano durante la fotosintesi del carbonio radioattivo. Gli
animali, compreso l’uomo, cibandosi di vegetali assumono a loro volta
14C.
Negli esseri viventi si
trova lo stesso rapporto tra 14C e 12C che
nell’atmosfera; questo rapporto può essere considerato costante per il
periodo di tempo che copre la storia dell’uomo.
Grazie al 14C
è possibile la datazione dei reperti antichi; infatti, il periodo di
dimezzamento ha un valore diverso per ogni elemento radioattivo e
rimane invariato qualunque sia la pressione, la temperatura o lo stato
di aggregazione del composto chimico di cui fa parte l’elemento. Per
questo motivo il decadimento radioattivo è utilizzato oggi come “
orologio nucleare”: la quantità residua di 14C presente nei
resti di organismi morti permette di stabilirne l’età in quanto,
quando un organismo muore, lo scambio di carbonio cessa e il carbonio-14 presente
nell’organismo che decade non viene più reintegrato dal nuovo
carbonio-14 dell’atmosfera.
Maggiore è l’età dei
resti di un organismo, minore è la quantità di carbonio-14 che
contengono.
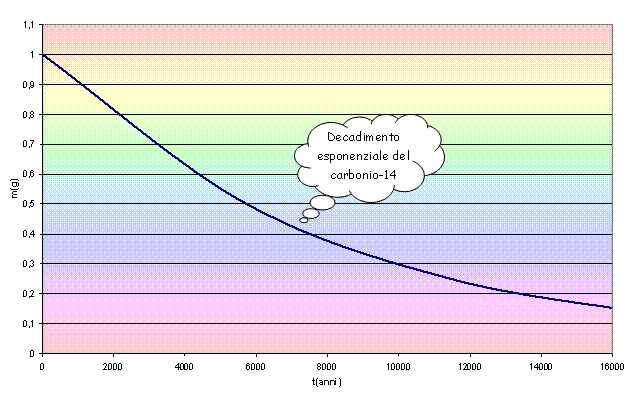
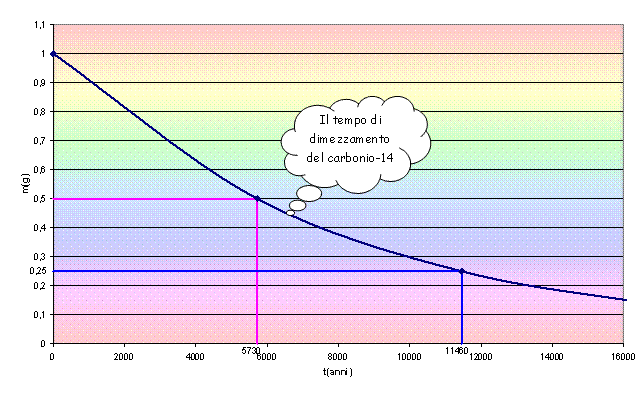
L’attività del
carbonio-14 in un essere umano è costante fino a quando muore; da quel
momento decresce esponenzialmente con T1/2 = 5730 anni, come
mostra il grafico sottostante.
Facciamo un esempio. Supponiamo di voler conoscere l’età di un
fossile in cui il 90%
del 6C14 è decaduto.

In tal caso, poiché la
massa è direttamente proporzionale al numero degli atomi da cui é
composta, la legge di
decadimento si può scrivere in questo modo:
mt/m0=e
–λt
dove mt
rappresenta la massa nell’istante finale t e m0 in quello
iniziale cioè quando l'essere vivente muore. Risulta che mt/m0=
1/10 per cui 1/10= e –λt che, per definizione di logaritmo,
implica
–λt = ln(1/10)
ossia
t =
ln10/λ.
Sostituendo in luogo di
t la sua espressione in termini del tempo di dimezzamento T1/2,
si ottiene
λ = 2/T1/2
Pertanto,
T =
(ln10/ln2)* T1/2≈19000 anni
è l'età del fossile
ritrovato.In realtà, il problema
della datazione è molto delicato perchè l'attendibilità dei risultati
può essere modificata da eventuali alterazioni avvenute nel tempo.

|
